编者按:1992年人类首次成功地应用低密度脂蛋白受体基因治疗家族性高胆固醇血症,揭开了心血管疾病基因治疗的序幕,此后基因治疗曾盛极一时。但2000年后,由于基因转移技术的限制、致癌风险和死亡病例的出现,人们对基因治疗安全性的关注更为强烈,相关治疗一度被打入冷宫。近年来由于基因转移技术的改进和心血管病相关基因的研究,心血管病的基因治疗又重新活跃起来。但是,我们对基因治疗诸多风险的关切和担忧仍未消失,心理上的种种阴霾阻碍着这一技术的研究开发和临床应用。
正方观点:心血管病基因治疗给力,无需考虑得失
祖凌云 高炜 北京大学第三医院心内科
安全高效的新型基因载体不断涌现
基因治疗成败的关键是基因治疗的载体系统。高效、安全是载体应具备的最基本条件。目前基因转染常用的载体有病毒型载体和非病毒型载体。病毒型载体转染效率高,但病毒蛋白有诱发机体产生免疫反应、体内潜在的病毒复制等缺点。特别是在1999年的基因治疗临床试验中出现腺病毒载体致人死亡事件后,人们把注意力逐步转向新型低免疫原性病毒载体和非病毒载体。
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。区别于一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有转染能力、长期的转基因表达而不发生免疫应答。研究发现,慢病毒载体能够成功地在体内和体外转染心肌,已成为心血管疾病研究中重要的基因传送载体。
腺相关病毒(AAVs)载体同样可以转染分裂与非分裂细胞,能够插入到宿主细胞染色体内或以染色体外串联体DNA的形式长期稳定表达,并且无致病原性,转染效率高,宿主范围广,极具应用前景。有研究发现腺相关病毒可高效地将外源基因转染到肌肉和心脏,是一种理想的心血管病基因治疗载体。
裸露DNA介导的基因治疗最为简单,它由编码生物活性物质的基因及作为其载体的质粒组成。自1990年首次报道骨骼肌内直接注射裸露DNA可实现肌肉介导的基因转移后,许多研究者又陆续报道了在心肌、皮肤、肝脏等组织中直接注射裸露DNA并成功实现基因转移和目的基因的表达。但它的主要缺点是稳定性和转染效率不高。研究发现,使用高频、低强度的超声波可以明显提高质粒的转染效率,电脉冲刺激也能明显提高质粒的转导效率(50~150倍)。近年来,北京大学心血管研究所、北大生命科学院等单位在电脉冲介导的裸DNA导入系统的研究中开展了卓有成效的工作,成功地将多种靶基因导入动物体内并获得高表达,如血管内皮细胞生长因子、促血管生成素-1、红细胞生成素等,为进一步的基因治疗研究打下了基础。
纳米载体是纳米技术快速向基因治疗领域渗透的产物。纳米微粒(nanoparticlcs,NP)一般指直径在10~500 nm范围内的超微固态胶状粒子。纳米基因传递载体(Nanoparticulate Carriers for Gene Delivery)简称纳米载体(nano-vectors),是指以纳米微粒为载体,将目的基因包含于微粒内部或吸附于表面,利用纳米微粒的小尺寸效应、比表面效应、界面效应等性质将目的基因转移到靶细胞内部,释放目的基因,从而达到基因治疗的最终目的。用于基因治疗的纳米微粒大多为高分子化合物,常用的有脂质体和阳离子聚合物。纳米基因载体具有转染效率高、安全低毒、无免疫原性的特点。纳米载体进入细胞后可透过核膜透入核内,介导外源基因与宿主细胞染色体DNA整合,获得长期稳定的表达。纳米载体经表面特异性靶向细胞的配体修饰后能被特异性受体识别并结合,进而靶向转染目的细胞,增强DNA的摄取和表达,从而实现目的基因的定向传递(图1)。利用不同的表面修饰,纳米微粒能够有效地决定外源基因在体内的走向、定位、传递以及高效表达,表现出优越的靶向性。
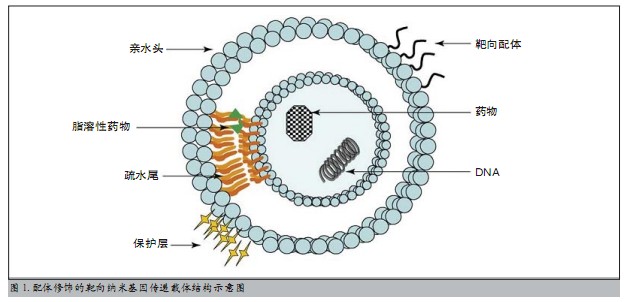
多基因联合治疗进一步提高心血管病基因治疗效果
缺血组织的血管新生过程需要多种生长因子在时间、空间和剂量等方面协调互补。生长因子之间通过合成分泌的相互调节、受体表达的相互调控、生物学效应的相互影响而形成精密调节的网络。因此,联合两个或多个作用于血管生成不同阶段的生长因子较单一因子可能会更有效地促进血管生成,改善组织血流。近些年,多基因联合治疗已受到研究者的关注。Yamauchi等人在兔下肢缺血模型上按不同的顺序联合转入质粒VEGF和Ang-1,发现先转入Ang-1质粒再转入VEGF质粒组的小动脉计数最高,动脉管径明显增加,且可避免水肿等不良反应。
Siddiqui等在小鼠心肌缺血模型心肌内注入phVEGF-A(165)和/或phAng-1,结果显示,在正常心肌组织中,动脉/毛细血管密度比与phVEGF的量成正比,而在缺血心肌动脉/毛细血管密度比则主要与phAng-1量相关。我们既往的研究也发现,在大鼠后肢缺血及小型猪心肌梗死模型中联合转染VEGF及Ang-1基因可更有效地促进血管生成,减少VEGF引起的水肿等不良反应。血管生长因子间相互依赖和调节的作用在FGF和NO,FGF-2和HGF的研究中也曾得到证实。
血管生长因子调控为心血管病基因治疗开辟了新思路
理想的基因转移不仅表达部位可控,表达的时机也应可控,即只在某种特定的病理状态下(例如缺氧、低血糖、血栓形成等)和特定的部位表达外源基因,其它时间则处于“关闭”状态。Philips等在AAV-GFP中插入心肌特异启动子MLC-2v,注入大鼠的外周静脉,4周后PCR结果显示各主要脏器组织中均存在载体序列,但 RT-PCR结果表明只有心肌组织表达外源基因,组织学检查也发现只有心肌表达GFP蛋白。Su等在AAV-VEGF165成功转染心肌组织的基础上,在普通SV40启动子前加入HRE序列,将载体注入正常或缺血的心肌组织中。研究发现,AAV-HRE VEGF165在缺血组织中的表达是正常组织的20倍,提示可以利用HRE控制外源基因在缺血心肌中的表达。我们的研究也表明携有缺氧反应元件的rAAV载体可在缺氧条件下调控VEGF的表达。另外的方法是应用一种能够调控基因表达开关的蛋白刺激多种生长因子协同作用的目的。上面提到的HIF-1α便具有这种特性,它能同时激活VEGF和Ang-2多种通路。肝细胞生长因子也具有这类特性,不仅促进血管生成,也可通过PR39peptide激活VEGF和FGF两条通路。
基因治疗与细胞治疗相结合的研究飞速发展
干细胞具有自我更新和多潜能分化的双重特性,加之易于采集、回输,有望成为基因治疗理想的靶细胞。基因治疗与干细胞治疗相结合不仅可以修复体内基因表达的缺陷,还可以发挥干细胞分化、再生和修复心血管病损伤能力。同时两者的结合既可利用基因载体扩大干细胞的用途以治疗更多的疾病,又可以避免单纯基因治疗的缺陷,具有安全、稳定而高效地表达、不引起免疫反应、可调节等优点。
Duan等将携带肝细胞生长因子(Hepatocyte Growth Factor,HGF)基因的腺病毒载体转染骨髓间充质干细胞,转染后的细胞高表达HGF达 2周以上,且转染 HGF对骨髓间充质干细胞的增殖及向成骨分化无影响。
联合应用内皮祖细胞移植和血管生长因子蛋白或基因,可能通过增加对血管生长因子反应能力强的内皮细胞的量而增强血管再生的效果。此外,还可以在体外将治疗基因导入内皮祖细胞后再植入体内。这些内皮祖细胞可起到生物工厂的作用,将生长因子带到特定的靶组织。由于使用的是自体细胞,避免了免疫排斥和炎症反应;在体外进行转基因操作时可采用电穿孔,逆转录病毒或慢病毒介导的基因整合等各种技术获得稳定表达生血管基因的细胞株,表达时间也大大延长。目前其可行性正在进一步研究中。
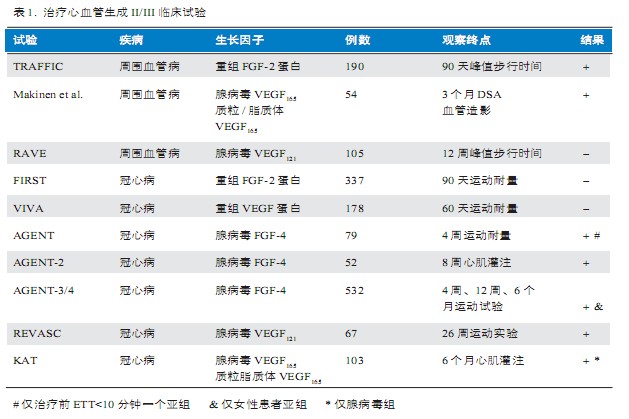
治疗性血管生成的临床试验结果令人鼓舞
近些年,治疗性血管生成在I期临床研究的基础上,进行了一些规模相对较大的、多中心随机双盲对照的II/III期临床试验(表1),大部分试验结果令人鼓舞,为患有冠心病和外周血管病而又无法进行手术的患者带来了新的希望。但也有一些II/III期临床试验结果疗效有限。
分析这些结果,有些因素值得我们考虑。研究中入选的病例大多是已接受过各种介入及外科手术治疗而未能取得满意疗效后转而接受基因治疗的,这些患者心肌坏死程度和范围较大,侧支循环形成的能力较差,即使给予了外源基因,由于自身缺乏“生长环境”,对基因治疗的反应不敏感。理想的研究对象应该是心肌缺血,或心梗后尚有存活心肌,且周围血流较丰富的患者。基因治疗的受众类型也影响其治疗效果。AGENT3/4研究发现,基因治疗后女性患者的运动耐量明显提高,提示可能存在尚未被人们了解的生物学因素参与或影响患者对血管生长因子的反应。此外,生长因子的种类、载体、转移方式及是否联合应用等都是影响生长因子最佳作用时间的重要因素。既往的研究(如FIRST试验和VIVA试验)显示,应用重组蛋白单一弹丸式注射并非理想选择。应用蛋白多聚体形式或是基因转移方式直接将药物注射到靶组织可能会获得更好的效果。
在临床试验中常用的基因导入方法是血管内注射,而心电标测定位注射系统(NOGA)能通过介入途径从心室腔内探测缺血心肌并实现经心内膜的心肌内注射。Kornowski等应用这种技术向猪的心内膜侧心肌注射报告基因,发现能够准确地将目的基因导入需要的部位并获得表达。Isner等进行的VEGF-2基因治疗冠心病的随机对照研究也采用了NOGA技术,获得了满意的疗效。与开胸注射相比,NOGA引导的经心内膜心肌内注射创伤小、更为安全,其对缺血心肌的识别能力在临床应用中也提供了更多的便利,是一种很有前途的方法。



 京公网安备 11010502033353号
京公网安备 11010502033353号